薬事法の名前が変わった?~医薬品医療機器等法、改正の3つのポイント
回答:2014年11月25日に改正された
旧薬事法は、2014年11月25日に改正され、「医薬品・医療機器等の品質、有効性及び安全性の確保等に関する法律」という名前の法律に変わりました。厚生労働省は、「医薬品医療機器等法」という略称を使用しています。
大きな改正のポイントは以下の3つです。
①「医療機器」を、「医薬品」と分けて個別に扱うようになった (スピードアップ)
②添付文書を”最新の情報・知見が反映されたもの”として明示 (安全対策の強化)
③再生医療の実現に向けた整備 (再生医療の実現)
変わったところ①:「医療機器」を、「医薬品」と分けて個別に扱うようになった
これまで、旧薬事法では「医療機器」については「医薬品」に準ずるものとして記載されてきましたが、「医薬品医療機器等法」では独立した章として取り扱われています。これは、「医療機器」と「医薬品」とでは非常に異なる状況にあることが背景です。
最近の「医療機器」は、パソコン等のIT製品と同様に日々改良・改善がなされ、1つの製品の寿命は非常に短く、速いサイクルで入れ替わっていきます。
そのため、製品寿命が長く入れ替わりも遅い「医薬品」と同じ扱いでは、色々と問題が生じるようになってきていました。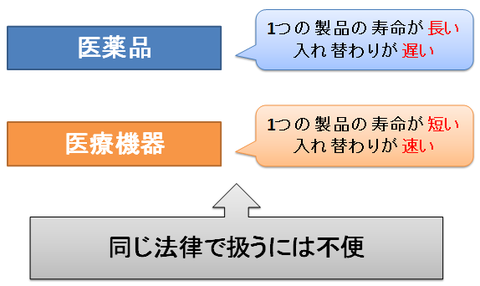
そのため、「医療機器」に関する条件や規制を簡略化・合理化する方向で定められ、”スピードアップ”に向けた動きと言えます。
例:医療機器の製造業が、許可制・認定制から登録制に変更され、要件が簡略化
変わったところ②:添付文書を”最新の情報・知見が反映されたもの”として明示
これまでも医薬品の添付文書は、唯一の法的根拠となり得る公的文書、という位置づけにあります。当然、その添付文書に記載された内容は、最新の情報・知見が反映されたものでなければなりません。
ところが、旧薬事法ではこうした最新の情報・知見を元に安全対策をする、ということが明確になっていませんでした。
「医薬品医療機器等法」では、添付文書を”最新の情報・知見が反映されたもの”と明示し、さらにWebサイトで最新の添付文書を掲載するなど、より迅速な情報提供が求められるようになります。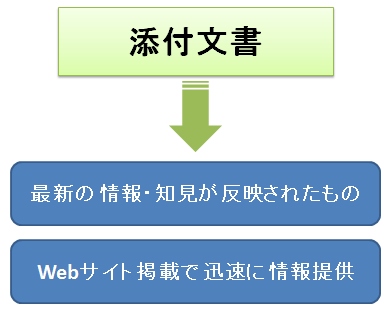
これは、最新の情報を活用して潜在的なリスクを防ごうとする、安全対策の強化と言えます。
変わったところ③:再生医療の実現に向けた整備
iPS細胞で話題となったように、再生医療に対する期待は非常に高くなっています。しかし、全く新しい分野のため、旧薬事法ではカバーできていませんでした。そこで「医薬品医療機器等法」では、医薬品・医療機器とは別に、「再生医療等製品」というものを新たに定義し、独立した章で取り扱っています。
また、「再生医療等製品」は、医薬品や医療機器とは異なり、完全に同一の製品を作ることはできません。そのため、医薬品や医療機器と同じような制度では、承認ができません。
そこで、「再生医療等製品」に関しては、条件・期限付きで早期に承認できる制度を導入しています。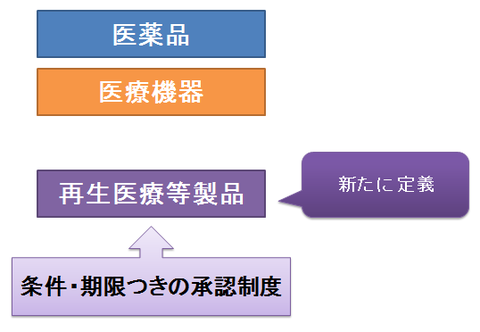
既に、この制度によって再生医療製品『ハートシート』が承認されるなど、新しい再生医療機器の導入が始まっています。
半世紀以上使われてきた「薬事法」の名前が変わることの意味
健康な生活を送っている人にとっては、今回の改正はそれほど大きく影響しません。医薬品でないものが効能・効果をうたえば法律違反になる等、変わらない部分が大半です。それでも、半世紀以上使われていた「薬事法」という名前を今回の改正で変更したことは、医療機器の実用化スピードアップ、安全対策の強化、再生医療の実現という3点において、並々ならぬ覚悟があるものと言えます。
~注意事項~
◆用法用量はかかりつけの主治医・薬剤師の指示を必ずお守りください。
◆ここに記載されていることは「原則」であり、治療には各々の環境や状況により「例外」が存在します。












この記事へのコメントはありません。